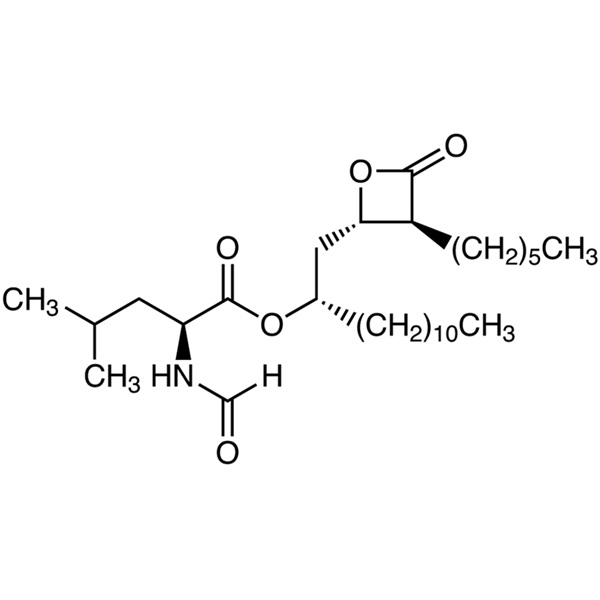
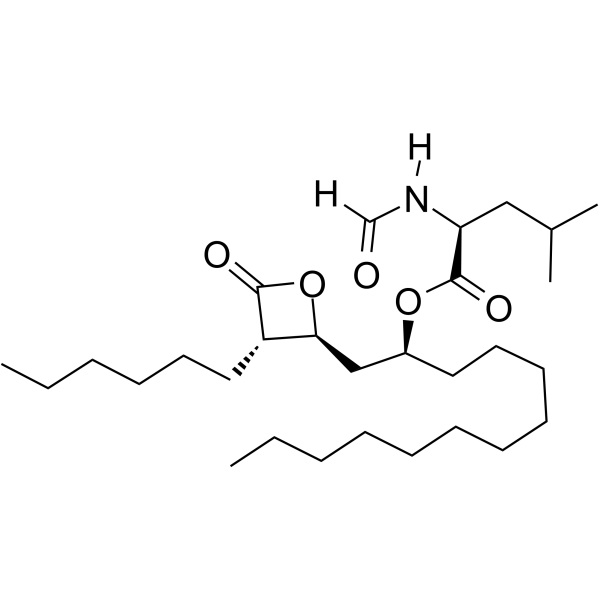
Orlistat CAS 96829-58-2 API 체중 감소 약물 순도 98.0~101.5%
Shanghai Ruifu Chemical Co., Ltd.는 고품질, 상업적 생산, 체중 감량 약물을 갖춘 Orlistat(CAS: 96829-58-2)의 선도적인 제조업체입니다. Ruifu Chemical은 전세계 배송, 경쟁력 있는 가격, 우수한 서비스, 소량 및 대량 수량을 제공할 수 있습니다. 올리스타트 구매, 문의처: alvin@ruifuchem.com
| 화학명 | 올리스타트 |
| 동의어 | N-포르밀-L-류신(1S)-1-[[(2S,3S)-3-헥실-4-옥소-2-옥세타닐]메틸] 도데실 에스테르; (S)-2-포르밀아미노-4-메틸-펜탄산(S)-1-[[(2S,3S)-3-헥실-4-옥소-2-옥세타닐]메틸]-도데실 에스테르 ; 테트라하이드로립스타틴; 로-18-0647 |
| CAS 번호 | 96829-58-2 |
| 재고현황 | 재고 있음, 생산 규모 최대 톤 |
| 분자식 | C29H53NO5 |
| 분자량 | 495.75 |
| 녹는점 | 43.0℃~48.0℃ |
| 밀도 | 0.976±0.06g/cm3 |
| 민감한 | 열에 민감한 |
| 용해도 | 클로로포름에 용해됨 |
| 배송조건 | 주변 온도에서 |
| COA 및 MSDS | 가능 |
| 브랜드 | 루이푸 화학 |
| 품목 | 사양 |
| 외관 | 흰색 또는 거의 흰색의 결정성 분말 |
| 신분증 A | 적외선 흡수 |
| 신분증 B | 검액의 주피크 유지시간은 정량법에서 얻은 표준액의 유지시간과 일치한다. |
| 순도/분석방법 | C29H53NO5 98.0~101.5%, 무수용매 기준으로 계산 |
| 특정 회전 | -48.0° ~ -51.0° |
| 물 측정 | 0.20% 이하 |
| 점화 잔류물 | 0.10% 이하 |
| 중금속 | 20ppm 이하 |
| 올리스타트 관련 화합물 A | 0.20% 이하 |
| 올리스타트 관련 화합물 B | 0.05% 이하 |
| 포르미류시네아 | 0.20% 이하 |
| 올리스타트 관련 화합물 C | 0.05% 이하 |
| 올리스타트 오픈 링 에피머 | 0.20% 이하 |
| D-류신 올리스타트 | 0.20% 이하 |
| 개별 미확인 불순물 | 0.10% 이하 |
| 올리스타트 관련 화합물 D | 0.20% 이하 |
| 올리스타트 오픈 링 아미드 | 0.10% 이하 |
| 올리스타트 관련 화합물 E | 0.20% 이하 |
| 총 불순물 | 1.00% 이하 |
| 테스트 표준 | 중국 약전; USP35 |
| 사용법 | 활성 제약 성분(API) |
패키지: 병, 알루미늄 호일 백, 25kg/Cardboard Drum 또는 고객 요구 사항에 따라.
보관 조건: 용기를 단단히 밀봉하여 서늘하고 건조한(2~8℃) 통풍이 잘되는 창고에 피해야 할 물질이 없는 곳에 보관하십시오. 강한 빛과 열, 습기를 피하세요.
배송: FedEx / DHL Express를 통해 항공으로 전 세계로 배송됩니다. 빠르고 안정적인 배송을 제공합니다.

올리스타트는 국제적으로 인정받은 새로운 형태의 체중 감량 약물입니다. 상품명은 Sainike이며 1998년 뉴질랜드에서 처음 판매되었습니다. Orlistat는 장기간에 걸쳐 매우 효과적인 특정 위장관 리파제 억제제로 물에는 녹지 않고 클로로포름에는 녹으며 에탄올에는 쉽게 녹습니다. Orlistat는 비만 치료에 임상적으로 사용될 수 있습니다. 보통 120mg을 1일 3회 식후 1시간 이내에 복용합니다. 체중 감량은 사용 2주 후에 시작됩니다. 6-12개월 동안 지속적으로 사용할 수 있으며 일일 복용량이 400mg을 초과하면 효과가 더 이상 증가하지 않습니다. 이 약은 비만 및 과체중인 사람의 저칼로리 식이요법과의 병용에 적합하며, 체중 관련 위험 요인에 직면한 환자의 장기 치료로도 사용할 수 있다. 오를리스타트는 체중을 감소, 유지하고 반등을 방지하는 장기적인 체중조절 효과가 있습니다. 오를리스타트를 사용하면 고콜레스테롤혈증, 제2형 당뇨병, 내당능 장애, 고인슐린혈증, 고혈압 등 체중 관련 위험인자와 질병의 발생을 낮출 수 있고, 장기 내 지방 함량을 줄일 수 있습니다. Orlistat는 또한 혈중 지질 수치를 조정합니다. 혈청 트리글리세리드(TG)와 저밀도 지단백 콜레스테롤(LDL-C)을 감소시킬 수 있으며, 비만 환자의 고밀도 지단백 대 저밀도 지단백의 비율을 증가시킬 수 있습니다.
올리스타트
C29H53NO5 495.73
l-류신, N-포르밀-, 1-[(3-헥실-4-옥소-2-옥세타닐)메틸]도데실 에스테르, [2S-[2(R*), 3]]-;
N-포르밀-l-류신, (3S,4S)-3-헥실-4-[(2S)-2-히드록시트리데실]-2-옥세타논 [96829-58-2]과 에스테르.
정의
Orlistat에는 무수용매 기준으로 계산한 C29H53NO5의 NLT 98.0%와 NMT 101.5%가 포함되어 있습니다.
식별
• A. 적외선 흡수<197M>
B. 검액의 주피크 유지시간은 정량법에서 얻은 표준액의 유지시간과 일치한다.
분석
• 절차
[참고-이 분석에서 용액을 준비하거나 담는 데 플라스틱 플라스크를 사용하지 마십시오. ]
이동상: 아세토니트릴, 인산, 물(860:0.05:140)
표준 용액: 이동상에 USP Orlistat RS 0.5mg/mL. 조제 후 즉시 주사하거나 5에 보관한다.
샘플 용액: 이동상에 Orlistat 0.5mg/mL. 조제 후 즉시 주사하거나 5에 보관한다.
크로마토그래피 시스템
(크로마토그래피<621>, 시스템 적합성 참조)
모드: LC
검출기: UV 195
컬럼: 3.9-mm × 15-cm; 4-μm 패킹 L1
유속: 1.0mL/분
주입 크기: 20 µL
시스템 적합성
샘플: 표준 용액
적합성 요구 사항
상대표준편차: NMT 2.0%
분석
시료: 표준용액 및 시료용액
Orlistat 부분에서 Orlistat(C29H53NO5)의 비율을 계산합니다.
결과 = (rU/rS) × (CS/CU) × 100
rU = 샘플 용액의 피크 응답
rS = 표준 용액의 최대 반응
CS = 표준 용액 내 USP Orlistat RS의 농도(mg/mL)
CU = 시료 용액 내 오를리스타트의 농도(mg/mL)
허용 기준: 무수, 무용제 기준 98.0%-101.5%
불순물
무기 불순물
• 점화 잔류물<281>: NMT 0.1%
• 중금속, 방법 II<231>: 20ppm
유기 불순물
• 절차 1: 오를리스타트 관련 화합물 A의 한계
표준 용액: 아세톤에 용해된 USP Orlistat 관련 화합물 A RS 0.1mg/mL
샘플 용액: 아세톤에 용해된 Orlistat 50mg/mL
크로마토그래피 시스템
(크로마토그래피 <621>, Thin-Layer Chromatography 참조)
모드: TLC
흡착제: 크로마토그래피 실리카겔 혼합물의 0.25mm 층
적용량: 10 µL
현상용매계: 톨루엔과 에틸아세테이트(4:1)
검출 용액: 인몰리브덴산 2.5g과 황산세륨 1g을 100mL 용량 플라스크에 넣고 용해시킨 후 메탄올로 부피만큼 희석합니다.
분석
시료: 표준용액 및 시료용액
플레이트를 꺼내서 충분히 건조시켜주세요. 건조된 판에 검출 용액을 뿌리고 판을 120도 오븐에 30분 동안 넣습니다.
허용 기준: 오르리스타트 관련 화합물 A에 해당하는 시료 용액의 2차 반점은 표준 용액의 해당 반점(0.2%)보다 더 강하지 않습니다.
• 절차 2: 오를리스타트 관련 화합물 B의 한계
표준 용액: 염화메틸렌에 용해된 USP Orlistat 관련 화합물 B RS 0.025mg/mL
샘플 용액: 염화메틸렌 중 Orlistat 50mg/mL
스파이크된 시료 용액: 표준 용액에 Orlistat 50mg/mL
크로마토그래피 시스템
(크로마토그래피<621>, 시스템 적합성 참조)
모드: GC
검출기: 화염 이온화
컬럼: 0.32-mm x 30-m 용융 실리카, 0.25-μm G27 고정상으로 코팅됨
컬럼 온도: 아래 온도 프로그램 표를 참조하십시오.
초기 온도() 온도 변화(/min) 최종 온도() 최종 온도 유지 시간(min)
50 4 170 -
170 30 300 30
온도
인젝터: 270
검출기: 280
운반 가스: 헬륨
유속: 30mL/분
분할 비율: 10:1
주입 크기: 2 µL
시스템 적합성
샘플: 표준 용액
적합성 요구 사항
상대표준편차: NMT 10.0%
분석
샘플: 샘플 용액 및 스파이크 샘플 용액
복용한 오를리스타트 부분에서 오를리스타트 관련 화합물 B의 백분율을 계산합니다.
결과 = [rU/(rSP rU)] × (CS/CT) × 100
rU = 시료 용액의 오르리스타트 관련 화합물 B의 피크 반응
rSP = 스파이크된 샘플 용액의 오르리스타트 관련 화합물 B의 피크 반응
CS = 표준 용액 내 USP 올리스타트 관련 화합물 B RS의 농도(mg/mL)
CT = 스파이크된 샘플 용액 내 오를리스타트의 농도(mg/mL)
허용 기준: 오르리스타트 관련 화합물 B가 NMT 0.05% 발견되었습니다.
• 절차 3
[참고-이 분석에서 용액을 준비하거나 담는 데 플라스틱 플라스크를 사용하지 마십시오. ]
이동상, 표준액, 검액 : 정량방법에 따라 준비한다.
시스템 적합성 솔루션: 이동상 내 USP Orlistat RS 10μg/mL, USP Orlistat 관련 화합물 C RS 0.1μg/mL, USP Orlistat 관련 화합물 D RS 0.25μg/mL
크로마토그래피 시스템
(크로마토그래피<621>, 시스템 적합성 참조)
시스템 적합성 용액의 크로마토그래피를 제외하고 분석 지침에 따라 진행합니다.
시스템 적합성
샘플: 시스템 적합성 솔루션
적합성 요구 사항
신호-대-잡음비: 오를리스타트 관련 화합물 C 및 오를리스타트 관련 화합물 D 피크에 대한 NLT 3
상대 표준 편차: orlistat 피크의 경우 NMT 10.0%
분석
시료: 표준용액 및 시료용액
Orlistat를 채취한 부분에서 각 불순물의 백분율을 계산합니다.
결과 = (rU/rS) × (CS/CU) × (1/F) × 100
rU = 샘플 용액의 각 개별 불순물에 대한 피크 반응
rS = 표준 용액의 USP Orlistat RS의 피크 반응
CS = 표준 용액 내 USP Orlistat RS의 농도(mg/mL)
CU = 시료 용액 내 오를리스타트의 농도(mg/mL)
F = 불순물 표 1에 제시된 상대 반응 인자
허용 기준: 불순물 표 1을 참조하십시오.
불순물 표 1
이름 상대 머무름 시간 상대 반응 인자 허용 기준, NMT(%)
포르밀류시네아 0.10 4.0 0.2
오르리스타트 관련 화합물C 0.13 33 0.05
올리스타트 개방환 에피머브 0.44 1.0 0.2
오르리스타트 관련 화합물 D* 0.90 - 다음으로 계산됨
절차 4
Orlistat 개방형 링 amidec* 0.90 - 다음으로 계산됨
절차 4
올리스타트 1.00 - -
d-류신 오르리스타트 1.18 1.0 0.2
개별미확인불순물 - 1.0 0.1
* 이 LC 시스템의 Coelutes는 절차 4를 사용하여 결정됩니다.
N-포르밀-l-류신.
b (2S,3R,5S)-5-[(S)-2-포르밀아미노-4-메틸-펜타노일옥시]-2-헥실-3-히드록시-헥사데칸산.
c N-포밀-l-류신(S)-1-[(2S,3S)-2-히드록시-3-[1-페닐-R-에틸카르보모일]노닐]-도데실 에스테르.
d N-포르밀-d-류신(S)-1-[[(2S,3S)-3-헥실-4-옥소-2-옥세타닐]메틸]도데실 에스테르 또는 거울상 이성질체.
• 절차 4: 오를리스타트 관련 화합물 D의 한계
이동상: 메탄올 및 물(83:17)
시스템 적합성 솔루션: 각각 아세토니트릴에 함유된 USP Orlistat RS 4 mg/mL 및 USP Orlistat 관련 화합물 D RS 2.4 µg/mL
표준 용액: 아세토니트릴에 용해된 USP Orlistat RS 5.0mg/mL
샘플 용액: 아세토니트릴 중 Orlistat 5.0mg/mL
크로마토그래피 시스템
(크로마토그래피 621, 시스템 적합성 참조)
모드: LC
검출기: 205nm
컬럼: 4.0-mm × 25-cm; 5-μm 패킹 L7
유속: 0.6mL/분
주입 크기: 20 µL
시스템 적합성
샘플: 시스템 적합성 솔루션
적합성 요구 사항
신호-대-잡음비: 오르리스타트 관련 화합물 D 피크에 대한 NLT 3
상대 표준 편차: orlistat 피크의 경우 NMT 10.0%
분석
시료: 표준용액 및 시료용액
Orlistat를 채취한 부분에서 각 불순물의 백분율을 계산합니다.
결과 = (rU/rS) × (CS/CU) × (1/F) × 100
rU = 샘플 용액의 각 개별 불순물에 대한 피크 반응
rS = 표준 용액의 USP Orlistat RS에 대한 최대 반응
CS = 표준 용액 내 USP Orlistat RS의 농도(μg/mL)
CU = 시료 용액 내 오를리스타트의 농도(μg/mL)
F = 불순물 표 2에서 얻은 상대 반응 인자
허용 기준: 불순물 표 2를 참조하십시오.
불순물 표 2
이름 상대 머무름 시간 상대 반응 인자 허용 기준, NMT(%)
오를리스타트 관련 화합물 D 0.94 1.0 0.2
올리스타트 1.00 - -
올리스타트 개방형 링 아마디아 1.25 4.3 0.1
N-포르밀-l-류신(S)-1-[(2S,3S)-2-히드록시-3-[1-페닐-R-에틸카르보모일]노닐]-도데실 에스테르.
• 절차 5: 오를리스타트 관련 화합물 E의 한계
완충액: 0.4N 붕산염 용액, pH 10.2로 조정됨
유도체화제: o-프탈데히드(OPA) 용액. [참고-상업적으로 구할 수 없는 경우 유도체화제는 0.4 M 보레이트 완충용액에 3-머캅토프로피온산과 오-프탈디알데히드를 각각 1%씩 첨가하여 제조할 수 있습니다.]
용액 A: 4.1g의 아세트산 나트륨 삼수화물과 40mg의 에틸렌디아민4아세트산(EDTA)을 1-L 용량 플라스크에 옮깁니다. 물 950mL에 녹이고 0.1N 수산화나트륨을 넣어 pH 7.2로 조정한다. 물로 희석하여 용량만큼 희석하고 테트라히드로푸란 2.5 mL를 넣어 섞는다. 필터 및 탈기.
용액 B: 2.7g의 아세트산 나트륨 삼수화물과 40mg의 EDTA를 1-L 용량 플라스크에 옮깁니다. 물 200mL에 녹이고 0.1N 수산화나트륨을 넣어 pH 7.2로 맞춘다. 800 mL의 아세토니트릴, 필터 및 탈기를 추가합니다.
이동상: 아래 기울기 표를 참조하세요.
시간(분) 용액 A(%) 용액 B(%)
0 96.7 3.3
20 60 40
24 0 100
38 0 100
38 96.7 3.3
45 96.7 3.3
표준용액 : USP 오를리스타트 관련 화합물 E RS 약 0.2mg을 칭량하여 20mL 헤드스페이스 바이알에 옮긴다. 4N 수산화나트륨용액 10mL를 넣고 바이알을 닫는다. 바이알을 100℃까지 1시간 동안 가열한 후 실온으로 냉각시킨다. 생성된 용액 2mL를 50mL 용량 플라스크에 옮기고 물로 희석합니다. 이 액 0.5mL에 완충액 2.0mL와 유도체화제 0.5mL를 첨가한다.
검액: 표준액의 지시대로 진행하되, 대신 USP 오를리스타트 관련 화합물 E RS 0.2mg을 대신하여 오를리스타트 25mg을 사용하십시오.
크로마토그래피 시스템
(크로마토그래피<621>, 시스템 적합성 참조)
모드: LC
검출기: 형광 340nm(여기); 450nm(방출)
열
가드: 2.1-mm × 2-cm; 50-μm 패킹 L1
분석: 2.1-mm × 20-cm; 포장 L1
유속: 0.5mL/분
주입 크기: 20 µL
시스템 적합성
샘플: 표준 용액
적합성 요구 사항
상대 표준편차: 오르리스타트 관련 화합물 E 피크에 대한 NMT 6.0%
분석
시료: 표준용액 및 시료용액
Orlistat를 채취한 부분에서 이 불순물의 백분율을 계산합니다.
결과 = (rU/rS) × (CS/CU) × 100
rU = 시료 용액 내 오르리스타트 관련 화합물 E의 피크 반응
rS = 표준 용액의 USP Orlistat 관련 화합물 E RS에 대한 피크 반응
CS = 표준 용액 내 USP 올리스타트 관련 화합물 E RS의 농도(mg/mL)
CU = 시료 용액 내 오를리스타트의 농도(mg/mL)
합격기준
개별 불순물 : 오르리스타트 관련 화합물 E가 NMT 0.2% 검출됨.
총 불순물: NMT 총 불순물의 1.0%가 발견되었으며, 절차 1, 2, 3, 4 및 5의 결과가 추가되었습니다.
특정 테스트
• 광학 회전, 특정 회전<781>
샘플 용액: 탈수 알코올 중 30mg/mL
허용 기준: 20에서 -48.0과 -51.0 사이
• 수분 측정, 방법 Ic<921>: NMT 0.2%
추가 요구 사항
• 포장 및 보관 : 밀폐용기에 담아 2~8℃에서 보존하세요.
• USP 참조 표준<11>
USP 올리스타트 RS
USP Orlistat 관련 화합물 A RS
USP Orlistat 관련 화합물 B RS
USP Orlistat 관련 화합물 C RS
USP 올리스타트 관련 화합물 D RS
USP Orlistat 관련 화합물 E RS
USP35